Vediamo l’importanza di due grandi scienziati italiani, attivi già nella seconda metà del ‘700: il medico, anatomista, fisiologo ed accademico bolognese Luigi Galvani(1737-1798) ed il chimico, fisico ed ingegnere Alessandro Volta (1745-1829). Uno dei loro principali campi di interesse fu il settore elettrico, ed in particolare il settore che si interessa degli effetti fisiologici dell’elettricità ed il settore elettrochimico che si interessa alle relazioni tra fenomeni elettrici e chimici.
Galvani scoprì, con i suoi famosi esperimenti sulle rane, la capacità dei nervi di trasmettere segnali elettrici che potevano provocare contrazioni e fibrillazioni dei corpi. La spiegazione di tipo prettamente fisiologico da lui data provocò una vivace polemica con Volta che dava una spiegazione diversa del fenomeno, più orientata verso la fisica. Entrambi, in realtà, fornivano elementi atti a comprendere a fondo il fenomeno.
Galvani è ricordato anche per aver messo a punto uno strumento, detto galvanometro, tuttora in uso in versioni perfezionate per la misura di correnti elettriche minime, e basato sulla capacità della corrente di provocare la torsione di un sensibile filamento. Si deve anche allo scienziato bolognese la messa a punto della galvanotecnica, cioè una tecnica atta a deporre uno strato protettivo metallico (ad esempio, di stagno) su un diverso metallo (ad esempio ferro). La tecnica consisteva nel far deporre lo strato protettivo in un bagno di una sostanza chimica (ad esempio un sale di stagno) capace di scindersi in due gruppi chimici (detti ioni) caricati con cariche elettriche di segno opposto a causa del passaggio di una corrente elettrica nel bagno. Il metallo da ricoprire ed un secondo oggetto, fatto di un metallo diverso, immersi nel bagno, funzionavano da poli positivo e negativo (detti anodo e catodo) tra cui passava la corrente. Il fenomeno descritto è alla base dell’elettrochimica.
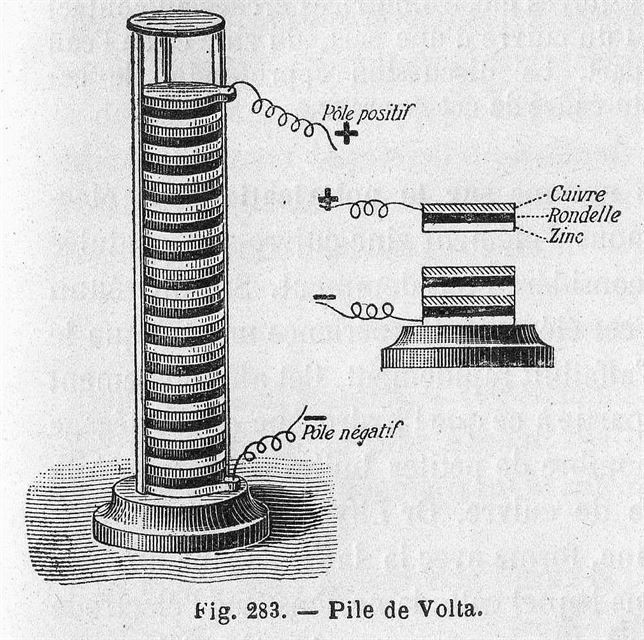
Sullo stesso principio era basata la celeberrima pila messa a punto da Volta alla fine del secolo e presentata anche alla Royal Society con comunicazioni del 1800-1801. In questo caso i poli metallici erano costituito da dischi di rame e stagno inframmezzati da feltri imbevuti di una soluzione di una sostanza chimica capace di scindersi formando ioni. I singoli gruppi di rame, stagno e feltro (che formano una singola “cella elettrochimica”) erano posti in serie (o “in batteria”) ed alle estremità della pila si generava una differenza di potenziale elettrico atto a creare una corrente come nelle moderne pile o batterie. Ancora oggi il potenziale elettrico (che è il livello energetico cui si trova una carica elettrica) è misurato in una unità di misura, il Volt, che prende il nome dal grande scienziato nato a Como. La pila fu presentata da Volta anche a Parigi alla presenza di Napoleone, di cui abbiamo più volte sottolineato l’interesse per la scienza e la tecnica. Volta fu premiato con una medaglia d’oro e l’ammissione all’Accademia di Francia. Anche la Royal Society britannica lo aveva premiato con la “medaglia Coplay” nel 1794.
Tuttavia la pila non fu l’unica grande invenzione di Volta. Nel 1775 lo scienziato aveva messo a punto l’elettroforo ad induzione perpetuo, basato sull’accostamento senza contatto di un disco metallico ad un altro caricato elettricamente con cariche negative (“elettroni”). L’influenza a distanza delle cariche elettriche del secondo disco – poiché le cariche dello stesso segno si respingono - provocava l’allontanamento degli elettroni nel primo disco, inizialmente scarico, ed il suo caricamento, a distanza, in senso positivo. Oggi sappiamo, infatti, che il caricamento positivo è dovuto solo all’allontanamento nel primo disco delle particelle dotate di carica negativa sempre presenti allo stato libero nei metalli, gli elettroni, di cui parleremo diffusamente nei prossimi numeri. Gli elettroni potevano poi essere allontanati continuamente dal primo disco toccandolo con un terzo conduttore e lasciando solo la carica positiva.
Sullo stesso principio è basato il condensatore, cioè un apparecchio formato da due dischi metallici contrapposti, messo a punto da Volta tra il 1778 ed il 1780 per l’accumulo e la conservazione di cariche elettriche. Volta individuò anche la legge che lega la carica elettrica Q del condensatore con la differenza di potenziale tra i due dischi V ed una costante C caratteristica del condensatore detta capacità: Q = CxV.
Il grande scienziato comasco, divenuto professore di fisica sperimentale e poi rettore dell’Università di Pavia, ed in contatto con Lavoisier, Laplace ed altri grandi scienziati dell’epoca, si interessò anche di chimica e leggi dei gas. Tra il 1776 ed il 1777 scoprì il metano (CH4) allora detto “gas delle paludi” perché si sviluppava dalla decomposizione delle piante negli acquitrini. Nel 1791 individuò la legge di variazione del volume dei gas a pressione costante con la temperatura, legge poi perfezionata 10 anni dopo dal francese Gay-Lussac (di cui si scriverà nel prossimo numero): V= kT. Nel 1795 aveva anche preceduto l’inglese Dalton (anche di lui parleremo nel prossimo numero) nella scoperta che i vapori provenienti dall’evaporazione di un liquido si sviluppano in un ambiente chiuso sempre con la stessa legge (la pressione del vapore cresce esponenzialmente con la temperatura : P = KT ) indipendentemente dal fatto che vi sia aria, o un altro gas, o il vuoto (il che significa che ogni vapore o gas esercita una sua pressione parziale indipendente dalle pressioni esercitate da altri gas o vapori).
Direttamente collegato alle realizzazioni di Volta furono le ricerche sperimentali sviluppate da un ottimo chimico inglese, Humphry Davy (1778-1829), di umili origini (era figlio di un falegname), ma poi diventato membro della Royal Society ed addirittura premiato anch’egli da Napoleone nel 1813 nonostante l’ostilità regnante tra Francia e Regno Unito.
Davy scoprì l’ossido di azoto noto come “gas esilarante” (ON2) e studiò altri composti dell’azoto. Servendosi di batterie basate sugli studi di Volta (che aveva incontrato personalmente in Italia) riuscì ad isolare in soluzione, o “bagno” elettrochimico, vari metalli (Calcio, Magnesio, Potassio, Sodio, Stronzio, Bario), grazie alla loro capacità di perdere elettroni trasformandosi in ioni positivi che si raccoglievano al catodo (polo negativo). Grazie allo stesso principio potè determinare anche la capacità dell’idrogeno (H) di formare ioni positivi (H+).
Scoprì anche un elemento non-metallico, lo Iodio (in collaborazione con Gay-Lussac) e dimostrò l’esistenza di acidi privi di ossigeno come l’acido cloridrico (HCl) dimostrando l’erroneità della tesi di Lavoisier secondo cui tutti gli acidi contenevano ossigeno. Progettò rivestimenti di rame (materiale che resiste alla corrosione) per rinforzare le fiancate delle navi.
Il suo nome è legato soprattutto all’invenzione della famosa lampada (che porta il suo nome) da allora usata nelle miniere di carbone perché progettata in modo da evitare gli scoppi dovuti al micidiale gas “grisou”che provocava stragi tra i minatori nelle miniere di carbone. Davy è famoso anche per aver assunto come assistente uno dei più grandi scienziati dell’800, Faraday (cui dedicheremo un prossimo numero), che lo stesso Davy presentava spiritosamente come “la mia più grande scoperta”.